Liste over vigtige begreber og forklaring af hvad, de betyder.
Aktiveringsenergi
Aktiveringsenergi er et kemisk udtryk for der beskriver hvor hurtigt en reaktion kan forløbe i forhold til bl.a. temperaturen. Jo mindre aktiveringsenergi, jo hurtigere reaktion. Enzymer kan ofte sænke en reaktions aktiveringsenergi.
Allel
En allel af et gen er en bestemt udgave af genet. Mange organismer har to alleler af hvert gen.
Aminosyre
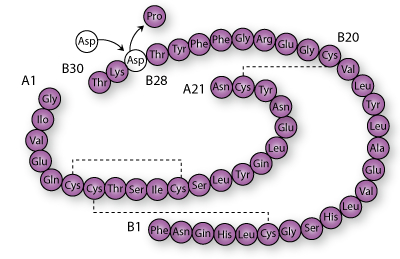
En aminosyre er en særlig kemisk gruppe af stoffer. De 20 biologiske aminosyrer indgår i forskellig kombination i de lange kæder, der udgør et protein. Alle aminosyrer indeholder en amin-gruppe (-NH3) og carboxy-gruppe (-COO-).
Antibiotikum
Et antibiotikum er et stof der virker imod bestemte mikroorganismer, som enten dræbes eller hæmmes i vækst.
Baseparring
Baseparring er den kemiske tiltrækning, der gør, at to DNA-strenge vil parres, hvis der overfor A sidder T, og overfor C sidder G.
Cellefabrik
En cellefabrik er en celle der producerer et værdifuldt produkt, oftest som følge af gensplejsning.
Codon
Et codon er tre af hinanden følgende nukleotider i et gen. Hvert af de 64 mulige codons koder for en aminosyre, som bliver en del af det protein, som codonets gen koder for. Codons kaldes også tripletter.
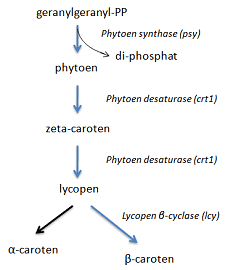
Den genetiske kode
Den genetiske kode er oversættelsen af hvilke aminosyrer, som de 64 mulige codons fører til. Se figur 1.3 i 1 Hvad er DNA og gener?
DNA
DNA lagrer alle cellers arvemateriale (generne) i lange dobbeltstrenge af nukleotiderne A,T,C og G. Det er rækkefølgen af disse der afgør hvilket protein, genet koder for.
DNA polymerase
En enzymtype, der kan kopiere DNA i en proces kaldet replikation.
Ekspression
I biologi er ekspression, når et gen aktiveres og derfor fører til dannelse af mRNA og sidenhen protein.
Ekspressionsvektor
En ekspressions-vektor er DNA, der indeholder de hjælpende DNA-elementer (promoter, terminator etc) der skal til for at udtrykke genet i en organisme. Læs meget mere i 3 Genetisk tuning.
Enzym
Enzymer er proteiner, der katalyserer bestemte biokemiske reaktioner og processer, dvs. sørger for at de foregår.
Fermentering
Fermentering er dyrkningen af mikroorganismer i beholdere (fermentorer). Læs mere.
Gelelektroforese
Gelelektroforese er en teknik til at adskille forskellig DNA eller protein i en prøve. Læs her.
Genom
Et genom er en organismes totale mængde af DNA-sekvens, dvs. alle gener og genregulerende områder m.m.
Glykosylering
Proteiner kan blive glykosyleret af cellerne, hvilket er en påhæftning af forskellige slags sukre. Glykosylering kan have betydning for halveringstiden af et medicinsk stof i blodet eller fx give bestemte signaler om proteinet til cellen.
Halveringstid
Halveringstiden er den tid, der skal gå, før koncentrationen af et stof er halveret. Bruges gerne om medicin i blodet.
Heterozygot
En heterozygot organisme har to forskellige alleler af et gen, og den dominante form vil kunne ses af fænotypen (hvordan organismen bliver).
Homozygot
En homozygot organisme har to ens alleler af det gen, man taler om. Hvis allelerne er den recessive (vigende) form, vil de ligesom den dominante form kunne ses af fænotypen (hvordan organismen bliver).
Katalyse
Katalyse af en reaktion vil sige at øge dens mulighed for at forløbe (gerne markant). Katalysen foretages af en katalysator (fx et enzym) som ikke forbruges i reaktionen selv.
Komplementære nukleotider
Nukleotider der passer sammen ved baseparring. Dvs. A-T og C-G.
Kromosom
Kromosomer er lange DNA-strenge. Ved almindelig (mitotisk) celledeling overføres en kopi af hvert kromosom til den nye celle.
mRNA
mRNA (messenger RNA) er en RNA-type. Den dannes ved transkription af de gener, der er aktive, og bruges i translationen til at danne protein.
Mutation
En mutation er en ændring i DNA-sekvensen, som kan opstå til gavn eller ulempe for cellen, fx ved UV-belysning. Celler, der er genetisk forandrede, kaldes mutanter.
Nukleotid
Den kemiske struktur, som DNA- og RNA-strengene bygges op af. Der eksisterer A, T, C og G. I RNA erstattes T af nukleotidet U.
Protein
Et protein er kemisk set en lang kæde af aminosyrer, som foldes på en bestemt måde og dermed får en funktion i cellen.
Rekombinant produktion
Produktion med gensplejsede organismer.
Replikation
Replikation er en cellebiologisk proces, hvor en DNA-streng kopieres i to. En DNA-dobbeltstreng skilles undervejs i to enkeltstrenge, som hver får påsat de komplementære nukleotider. Resultatet er dermed to dobbeltstrenge.
Restriktionsenzym
Et restriktionsenzym (eller restriktionsendonuklease) er i stand til at skære en DNA-dobbeltstreng over ved en bestemt sekvens.
Screening
Screening er en metode, der kan bruges til at kende særlige genetiske varianter fra de andre.
Selektion
Selektion er en metode, hvor man etablerer nogle forhold for organismerne, som gør at de interessante overlever og dermed udvælges. Læs mere.
Southern blot
Southern blotting bruges til at søge efter tilstedeværelsen af en specifik DNA-sekvens i en DNA-prøve ved hjælp af baseparring med en probe. Læs mere.
Transgen organisme
En organisme, der indeholder gener fra en fremmed organisme.
Transkription
Transkription er en proces, hvor aktive gener afskrives fra DNA’et til mRNA, som kan bruges i cellen til translation.
Translation
Translation er en proces, hvor mRNA oversættes til protein i et ribosom. Hver codon (tre nukleotider) oversættes til en aminosyre efter den genetiske kode.
Udtryk
Se ekspression