Syntetiske antistoffer
Denne underside udgør fjerde del af teorien for Biotech Academys materiale om Immunforsvaret.


Denne underside udgør fjerde del af teorien for Biotech Academys materiale om Immunforsvaret.
Eftersom sygdommen kopper er en virussygdom, der ikke kan behandles med almindelige antibiotika, er den bedste behandling en egentlig forebyggelse ved vaccination. Da Kopper er erklæret udryddet på verdensplan, vaccinerer man ikke længere befolkningen mod sygdommen. Der er dog i nyere tid opstået ny frygt for sygdomsudbrud. Det skyldes, at der eksisterer frygt for, at nogle lande har sat produktion af virussen i gang til et biologisk angreb. Med den høje dødelighed af sygdommen ville det have katastrofale følger, hvis et angreb fandt sted. I Danmark findes der nok koppevaccine på lager til at kunne dække den danske befolkning, men har et angreb allerede fundet sted, vil det være for sent for mange mennesker at blive behandlet.
Vaccination mod koppevirus blev kendt allerede i 1790’erne, hvor Edward Jenner overførte koppevirus fra køer til mennesker. Koppevirus fra køer er en anden form end den, som inficerer mennesker, og resulterer sjældent i sygdom blandt mennesker. Denne overførsel førte blandt forsøgspersonerne til krydsimmunitet over for den koppevirus, som inficerer mennesker, formentlig på grund af den store lighed mellem de forskellige vira. Ko-typen af kopper hedder vaccinia (fra den latinske betegnelse for en ko ”vacca”), og deraf stammer ordet vaccination.
Desværre kan der ved denne slags vaccination være alvorlige bivirkninger, som rammer omkring 1 ud af 1000 vaccinerede. Man kan reducere bivirkningerne ved at give anti-vaccinia antistoffer, altså antistoffer, som genkender antigener på vaccinia-virussen og dermed assisterer immunsystemet. Disse antistoffer kan isoleres hos tidligere vaccinerede individer, men eftersom denne gruppe af mennesker bliver mindre og mindre, er det blevet svært at anskaffe sig antistoffer på denne måde. Anti-vaccinia antistoffer ville også kunne anvendes ved et sygdomsudbrud, idet de kan gøre et sygdomsforløb mildere for en person, som er smittet med kopper uden at være vaccineret i tide. Det ville derfor være hensigtsmæssigt at kunne producere anti-vaccinia eller endda anti-kopper antistoffer.
Når man skal producere syntetiske antistoffer, udnytter man det kendskab, man har til immunforsvarets naturlige produktion af antistoffer. Det vil sige, at man stimulerer et immunforsvar med et antigen, så immunforsvaret selv danner antistoffer imod netop dette antigen. Antigenet kan på den måde være næsten hvad som helst, så længe det bliver opfattet som fremmed af det udsatte immunforsvar. Det sker ofte med tilsætning af en adjuvant for at sikre et tilstrækkeligt immunologisk respons.
Da antigener og adjuvanter kan være farlige for mennesker, og da cellerne også er svære at isolere efterfølgende, bruger man ofte mus til at udvikle antistoffer. Når man har stimuleret musens immunforsvar, giver man det tid til at reagere og udvikle optimale antistoffer, hvilket ofte tager over en uge – det såkaldte primære respons. Man høster derefter de udviklede plasmaceller ved at udtage musens milt. Milten er et organ fyldt med lymfoidt væv, og den har derfor også en stor koncentration af lymfocytter, herunder plasmaceller. I alt indeholder milten 15 % af kroppens B-lymfocytter, og man har derfor en stor chance for at finde en plasmacelle, der producerer antistoffer imod det ønskede antigen.
Når man har udtaget milten, har man dog ikke kun fået fat i plasmaceller, og cellerne skal derfor sorteres. Derudover kan plasmaceller ikke overleve særligt længe uden for kroppen. Man løser disse problemer i to trin. Først fusioneres plasmacellerne med myelomaceller (cancer-plasmaceller) og danner såkaldte hybridomaceller – se figur 11. Disse cancerceller har næsten ubegrænset levetid. Derefter tilsætter man et vækstmedium – dvs. den næring som celler lever af – som kun korrekt fusionerede plasma-myeloma hybridomaceller kan overleve i. Dermed får man både isoleret plasmacellerne og sikret, at de kan overleve uden for kroppen, som hybridoma celler.
Men de isolerede hybridomaceller stammer ikke alle sammen fra den antigen-adjuvant stimulering, som man startede ud med.
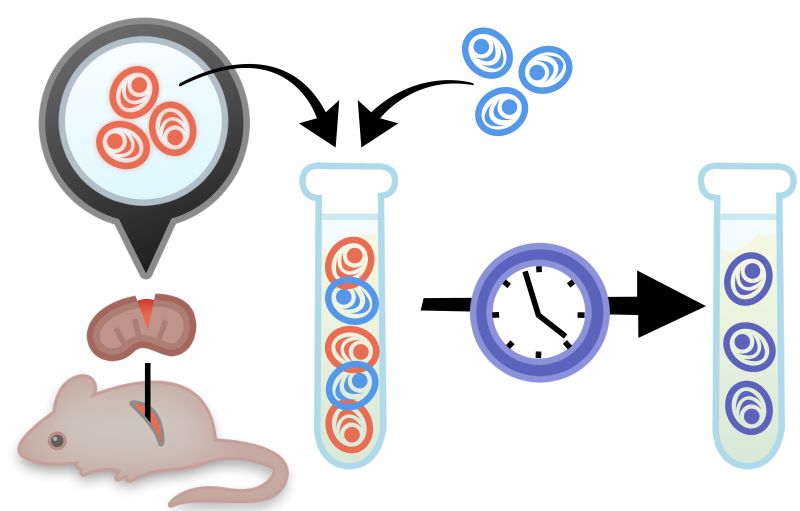
Figur 11. Denne figur viser, hvordan musecellerne bliver fusioneret med opdyrkede cancerceller. Den endelig fusionerede celle kaldes en hybridomacelle. Denne celle har både en lang levetid og er i stand til at dele sig.
Det er også andre plasmaceller, der producerer alle mulige forskellige antistoffer, som musen har haft brug for og derfor produceret i løbet af sit liv. For at finde frem til de hybridomaceller der producerer antistoffer specifikke for det ønskede antigen, må man derfor fordele cellerne enkeltvis i brønde på en mikrotiterbakke, så man kan teste de enkelte antistoffer – se figur 12. Her producerer cellerne antistoffer, og man kan så teste væsken (med antistof, uden celle) fra hver brønd i et indirekte ELISA. Hvis der er reaktion med det ønskede antigen i et indirekte ELISA ved man, at der findes antistof, som har bundet antigenet. Man kan så gå tilbage til mikrotiterpladen med plasmacellerne og finde den celle, som den positivt testede væske med antistof kom fra. Denne celle indeholder DNA for det antistof, som man er interesseret i at producere. Dette DNA kan sekventeres og bruges til at producere nye antistoffer i andre celler.
Selv om immunforsvaret i klodens forskellige pattedyr i store træk er forbløffende ens, så er der stadig små forskelle i de proteiner, vi producerer. Det antistof, som en hybridomacelle producerer, vil stadig være muse-antistoffer – eller murine antistoffer.
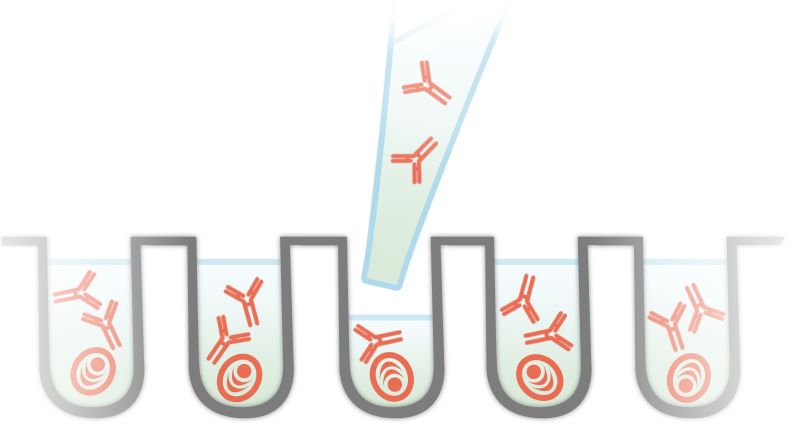
Figur 12. Denne figur viser, hvordan plasmacellerne er fordelt i hver sin brønd, hvor de producerer hver deres specifikke antistof.
Hvis man giver dem direkte til mennesker, så vil menneskets immunforsvar opfatte muse-antistofferne som fremmede og reagere imod dem. En sådan reaktion vil modvirke antistoffets funktion som lægemiddel.
Reaktionen kan begrænses ved, at man sammensætter menneskeligt DNA med DNA fra de isolerede museantistoffer. Det foregår ved genetisk rekombination. På den måde formindsker man det fremmede element af antistoffet, og dermed formindskes immunforsvarets tendens til at anse det for fremmed. Resultatet bliver et kimærisk antistof (opkaldt efter et sagndyr i den græske mytologi), hvor de menneskelige konstante regioner og de variable regioner fra musen er sammensat.
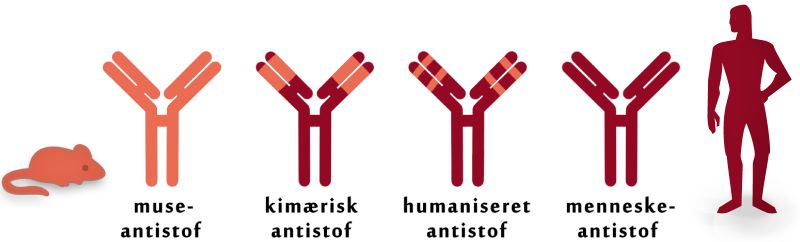
Figur 13. Figuren viser, hvordan man kan sammensætte et antistof af både menneskets og musens DNA. På den måde skabes et kimærisk antistof.
Når man har rekombineret DNAet fra menneske og mus, kan man indsætte det i produktionsceller vha. af en vektor. En ofte anvendt vektor er et plasmid. Det er et lille cirkulært DNA, som mange bakterier indeholder naturligt. Dette plasmid kan optages i en celle, og under de rigtige forhold kan der findes udskiftning af gener sted mellem vektoren og det kromosomale DNA. En vektor kan også være en virus, da disse, som beskrevet i afsnittet ” Bakterier og virus”, indsætter deres DNA i værtscellens.
Det har vist sig, at disse produktionsceller skal være pattedyrsceller for at opnå den helt rigtige efterbehandling af antistoffet inde i cellen. Man har fundet ud, at CHO-celler – Chinese Hamster Ovarian cells – altså celler fra hamsteræggestokke er gode at bruge, og de er derfor de mest anvendte.
Man kan fx få et plasmid ind i en produktionscelle ved elektroporation. Det er en proces, hvorved man får cellerne til at optage DNA – i dette tilfælde plasmidet – fra den omgivende væske. Ved at give plasmidet nogle promotorer, der bliver genkendt i produktionscellen, vil DNA’et på plasmidet blive aflæst og udtrykkes.
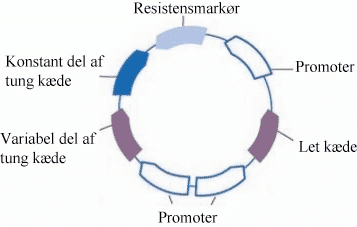
Figur 14. Figuren viser et plasmid, som indeholder de gener, man fx kunne indsætte i en organisme for at producere antistoffer. Promotorerne og resistensmarkører muliggør produktionen, mens to tunge og to lette kæde tilsammen danner et funktionelt antistof.
Som nævnt i afsnittet om immunforsvaret kan polyklonale antistoffer forventes at være mere effektive end monoklonale antistoffer over for komplekse antigener, som ses hos vaccinia og koppevirus. Det skyldes ganske enkelt at flere forskellige mål, i form af antigener på den invaderende mikroorganisme, tillader at flere antistoffer bliver bundet.
Symphogen A/S bruger blodprøver fra vaccinerede britiske ambulance-chauffører som udgangsmateriale i deres anti-vaccinia virusprojekt. Fra disse blodprøver genererer de, bl.a. ved brug af genteknologi, rekombinante polyklonale antistoffer, som kan fremstilles industrielt, og som vil afspejle den sammensætning af antistoffer, der er dannet af immunforsvaret hos de vaccinerede donorer. Fordelen er, at man her får fuldstændigt humane antistoffer, men det er til gengæld også sværere at få fat i de rigtige plasmaceller, end hvis man fx udtager en milt.
Symphogen A/S har som nævnt udviklet deres egen metode, hvormed de kan kopiere polyklonale antistoffer ved hjælp af genteknologi. Denne metode er kaldt Symplex-teknologien. Formålet er, at fremstille en blanding af antistoffer imod forskellige antigener, der afspejler den blanding, der findes i en immun person. Denne naturlige immunitet kan være opstået efter sygdom eller efter vaccination, og er fx rettet imod flere antigener på samme bakterier. Denne metode er dyrere end at fremstille de monoklonale antistoffer, men kan også forventes at være mere effektiv i bekæmpelsen af sygdom.