Genkend metabolitter
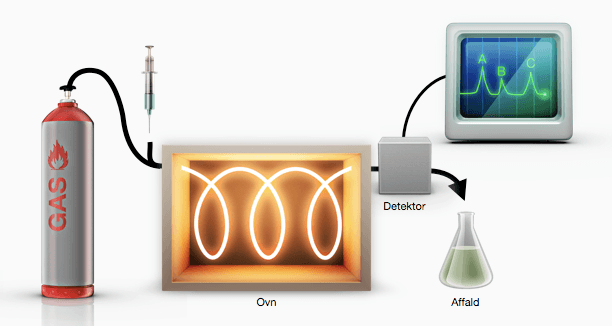
Den store variation i smagen af forskellige oste skyldes som nævnt tilstedeværelsen af blandt andet methylketoner. For nøjagtigt at bestemme de stoffer der er til stede i en ost, og dermed hvilke molekyler der er skyld i ostens smag, kan oste-ekstrakter analyseres ved kromatografi. Kromatografi er et begreb der dækker over en række analysemetoder, der alle bygger på adskillelse af de molekyler, der er til stede i en prøve. Kromatografi blev oprindeligt anvendt i 1901 af botanikeren Mikhail S. Tsvet, der benyttede den til adskillelse af farvestoffer fra planteekstrakter. Ordet stammer fra græsk, chroma betyder farve og grafi skrive, hvorfor kromatografi betyder skrivning med farve.
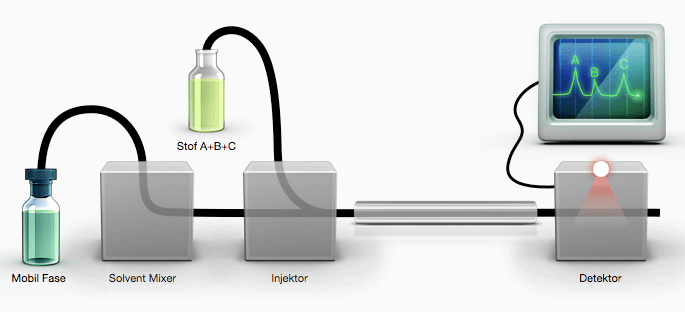
Tre vigtige former for kromatografi er – high-performance liquid kromatografi (HPLC), tyndtlagskromatografi (TLC) og gaskromatografi (GC). De bygger alle på samme overordnede princip, der involverer en stationær fase (fast stof) og en mobil fase (væske eller gas). Den mobile fase benyttes til at bevæge prøven gennem den stationære fase som illustreret i figur 1. Da de forskellige stoffer i prøven binder sig forskelligt til de to faser, vil de bevæge sig med forskellig hastighed, og derved bliver de adskilt. De forskellige bindinger, der findes mellem prøven og faserne, er beskrevet i afsnittet ”Intermolekylære kræfter”.
Intermolekylære kræfter
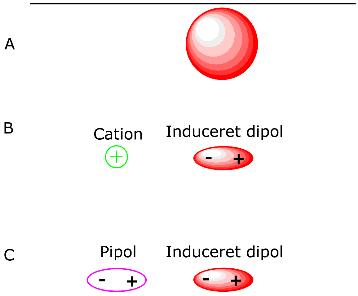
Elektronegativiteten af et atom, er et udtryk for, hvor godt stoffet kan tiltrække og holde på elektroner i kemiske bindinger. Jo højere elektronegativitet et atom har, jo bedre holder det så at sige på elektronerne. I en binding mellem to atomer med forskellig elektronegativitet, vil den delte elektronsky være forskudt mod det atom, der har den højeste elektronegativitet. Elektronegativitet angives som en tal-værdi, og et atoms elektronegativitet er bestemt relativt ud fra hydrogen, hvis elektronegativitet er sat til 2,2. Den benyttes da som reference, og et atoms elektronegativitet får en værdi i forhold til hvor elektronegativt det er, sammenlignet med hydrogen. I kan se en oversigt over atomer og deres elektronegativitet HER. Hvis forskellen i elektronegativitet er mere end 0,5, siges bindingen mellem de to atomer at være polær. Der vil da være en negativ og en positiv ende af bindingen. Hvis de intermolekylære bindinger ikke, på grund af symmetrier i molekylet, neutraliserer hinanden, vil stoffet udadtil være polært, og have hhv. en positiv og en negativ ende. Molekylet kaldes da en dipol. Den positive ende betegnes δ+ og den negative δ-. For en god ordens skyld skal forskellen på intermolekylære- og intramolekylære bindinger lige nævnes. Intermolekylære bindinger, og i øvrigt intermolekylære kræfter, betyder bindinger eller kræfter der virker mellem molekyler. Et eksempel er vand, der jo er bygget op af en masser H2O molekyler. De bindinger der bliver dannet mellem de enkelte H2O molekyler, er da intermolekylære.
Intramolekylære bindinger derimod, er bindinger der er inde i selve molekylet, mellem de enkelte atomer. Bindingen mellem H og O i H2O er da en intramolekylær binding, fordi den er inde i et molekyle.
Hydrogenbindinger:
Hydrogenbindinger er de stærkeste intermolekylære bindinger. Svagt elektropositive hydrogenatomer, der sidder i polære bindinger, kan indgå i hydrogenbindinger med elektronegative atomer som O, N eller F enten intramolekylært eller intermolekylært. Hydrogenbindinger kan variere fra meget svage til ekstremt stærke. Styrken af en binding, vurderes ud fra hvor meget energi, der skal til for at bryde bindingen.