Diagnostik af sygdomme
Denne underside om Diagnostik af sygdomme udgør fjerde del af teorien for Biotech Academys materiale om Genetik.
Genetiske sygdomme er ubehagelige. Der er ikke nogen livsstil, der medfører genetiske sygdomme. Patienterne er født med sygdommen, og en stor del af sygdommene fører til en nedsat, forventet levetid og nedsat livskvalitet.
Forskellige genetiske sygdomme har forskellige symptomer. Nogle genetiske sygdomssymptomer er visuelle, såsom unikke ansigtstræk i patienter med Downs syndrom, mens andre sygdomme ikke har nogle tydelige symptomer før patienten er over 30 år, såsom Huntingtons sygdom. Fælles for alle genetiske sygdomme er dog, at de viser sig som fejl i patientens DNA, og man kan derfor, med de rigtige analyser, finde disse DNA-fejl for at give en diagnose. Alle arvelige sygdomme er genetiske, men det er ikke alle genetiske sygdomme, som er arvelige. Downs syndrom er ikke et resultat af nedarvede fejl, derimod er det en kromosom fordelingsfejl under befrugtningen, der medfører sygdommen. Genetiske sygdomme er en fællesbetegnelse for kromosomfejl såvel som genetiske fejl, og genetiske sygdomme er derfor en bredere betegnelse end arvelige sygdomme.
Ved diagnosticering af genetiske sygdomme skelner man typisk mellem diagnostiske undersøgelser, som har til formål at be- eller afkræfte om en patient har en genetiske sygdom og prædiktive undersøgelser. Prædiktive undersøgelser har til formål at analysere, om en person er prædisponeret til at udvikle en kendt genetisk sygdom. Hvis et par planlægger at blive gravide, kan man også foretage en såkaldt anlægsbærerundersøgelse, hvor forældrenes DNA bliver analyseret for sygdomsfremkaldende mutationer. Hvis man foretager en anlægsbærerundersøgelse, viser den, om man har en muteret allel, som kan gives videre til ens børn.
The Human Genome Project og dets indflydelse på genetik
Hvordan kan vi vide, hvordan en vildtype eller en muteret allel ser ud? Svaret er at vi lige siden 2003 har kendt mennesket genom takket være The Human Genome Project (HGP). HGP var et 13årigt projekt, som havde til formål at lave et genetisk kort over alle de menneskelige gener. Vi har derfor lige siden slutningen af HGP kendt alle DNA-positioner i genomet, og vi har derfor en reference at sammenligne med, når vi skal stille diagnoser på simple genetiske sygdomme, der er forårsaget af enkelte eller få fejl i vores DNA-sekvens.
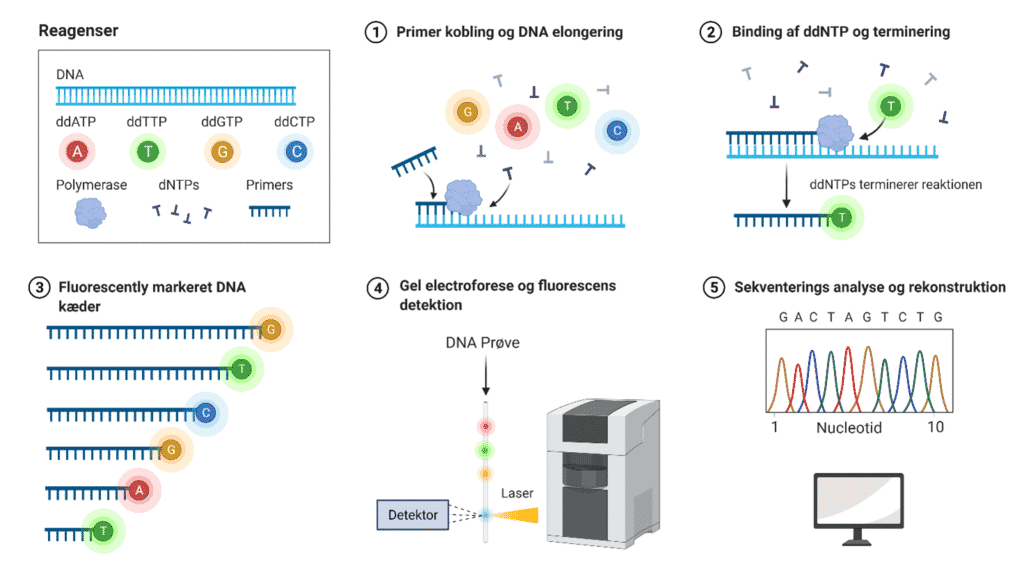
Genetiske undersøgelser
Ved diagnostiske undersøgelser kan patienter, der viser symptomer, eller asymptotiske personer blive testet for diverse genetiske sygdomme. Måden testen bliver udført på er ved først at tage nogle celler fra patienten. De bliver typisk taget fra indersiden af kinden eller ved en blodprøve. Cellerne indeholder patientens DNA, og det kan nu undersøges. Der er flere forskellige metoder, som bliver anvendt til at undersøge DNA’en. Den mest normale er en gen-sekvensering (se sektionen med gen-sekvensering). For at lægerne kan lave en gen-sekvensering, skal DNA’en først kopiers, så lægerne har nok DNA at arbejde med. Det bliver gjort med en PCR-test. PCR står for Polymerase Chain Reaction, og er en fundamental metode, som bliver brugt inden for bioteknologi, medicin, biologi, retsmedicin mm. Den benytter et af naturens egne enzymer til at generere mange millioner kopier DNA. Biotech Academy har en artikel omkring PCR her.